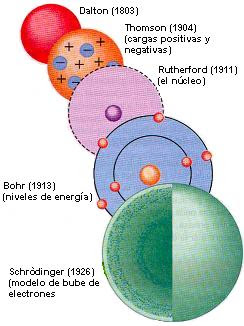
Modelo de Dalton 1766-1844
Su teoría se resume en lo siguiente:
1.Los elementos químicos están formados por partículas muy pequeñas e invisibles átomos.
2.Todos los átomos de un elemento químico dados son idénticos en su masa y demás propiedades.
3.Los átomos de diferentes elementos químicos son distintos en particular sus masas son diferentes.
4.Los átomos son indestructibles y tienen su identidad en los cambios químicos.
5.Los compuestos se forman cuando átomos de diferentes elementos se combinan entre si en una relación de números enteros formando las llamadas moléculas.
Para Dalton los átomos eran esferas macizas.
Modelo de Thomson
1898-1904
Este modelo justifica 2 hechos:
1.La materia es electricamente neutra, lo que hace pensar que ademas de electrones debe de haber partículas con carga positiva.
2.Los electrones pueden extraerse de los átomos pero no así las cargas positivas.Propuso un modelo en el átomo en el que la mayoría de la masa aparecía asociada con la carga positiva y suponiendo que había un cierto numero de electrones distribuidos uniformemente dentro de esa masa de carga positiva.
Modelo de Rutheford
1911
Rutheford poseía información sobre el tamaño, y carga del núcleo pero no sabia acerca de la posición de los electrones . En este modelo los electrones se movían alrededor del núcleo como si fueran planetas alrededor del sol.
Modelo de Bohr
1885-1962
Fue un físico Danes el cual formulo un nuevo modelo el cual implicaba los siguientes postulados:
1.El electrón tenia ciertos estados definidos estacionarios de movimiento a estos estados se les llamaba niveles de energía.
2.Cuando un electrón estaba en uno de esos estados no irradiaba energía pero cuando cambiaba de estado absorbía o desprendía energía.
3.En cualquiera de esos estados el electrón se movía siguiendo una órbita circular alrededor del núcleo.